La naloxona, también conocida con el nombre comercial Narcan, es uno de los medicamentos más importantes en la lucha de Estados Unidos contra la crisis de los opioides. Revierte una sobredosis de opioides casi instantáneamente, reiniciando la respiración en una persona que no respondía momentos antes y al borde de la muerte. Para los transeúntes que presencian su administración, la naloxona puede parecer casi sobrenatural.
Aunque la Administración de Alimentos y Medicamentos aprobó la naloxona para uso médico en 1971 y para su compra sin receta en 2023, todavía no está claro exactamente cómo funciona. Los investigadores saben que la naloxona actúa sobre los receptores opioides, una familia de proteínas responsables de la respuesta del cuerpo al dolor. Cuando los opioides como la morfina y el fentanilo se unen a estos receptores, no sólo producen alivio del dolor y euforia, sino también efectos secundarios peligrosos. La naloxona compite con los opioides por el acceso a estos receptores, evitando que las drogas causen efectos en el cuerpo. Sin embargo, la pregunta es cómo funciona a nivel molecular.
En nuestra investigación recientemente publicada en la revista Nature, mi equipo y yo pudimos proporcionar evidencia definitiva de cómo funciona la naloxona al capturar imágenes de ella en acción por primera vez.
Saber cómo usar naloxona puede salvar vidas. La biología de los opioides.
Para comprender mejor cómo funciona la naloxona, es útil analizar primero la biología detrás del opioide.
Un miembro de la familia de receptores opioides, MOR (abreviatura de receptor opioide µ) es un actor central en la regulación de la respuesta del cuerpo al dolor. Se encuentra en la superficie de las neuronas, principalmente en el cerebro y la médula espinal, y actúa como nodo de comunicación.
Cuando un opioide (como la endorfina, el analgésico natural del cuerpo) interactúa con MOR, cambia la estructura del receptor. Este cambio de forma permite que lo que se llama proteína G se una al receptor y active una señal al resto del cuerpo para reducir el dolor, inducir placer o, en el caso de una sobredosis, una respiración y un ritmo cardíaco peligrosamente lentos.

Cuando la molécula se une al receptor opioide µ, cambia su estructura y provoca un efecto. Los antagonistas como la naloxona inactivan el receptor opioide µ, mientras que los agonistas como el fentanilo lo activan. Cuenta Bens/Wikimedia Commons
En términos cotidianos, MOR es como un candado en el exterior de una celda. La proteína G es el mecanismo dentro de la cerradura que gira cuando se inserta la llave correcta (en este caso, una endorfina o un fármaco como el fentanilo). Durante décadas, los científicos creyeron que la capacidad de un opioide para activar esta cascada de señalización estaba relacionada con la eficacia con la que reformaba la estructura del receptor; esencialmente, si la cerradura podía abrirse lo suficiente como para que se activara la maquinaria interna de la proteína G.
Sin embargo, investigaciones recientes (incluido nuestro trabajo) han descubierto que el paso crítico en el funcionamiento de los opioides no es qué tan bien abren la cerradura, sino qué tan bien funciona el mecanismo. Las proteínas G actúan como un interruptor, liberando una molécula a cambio de otra molécula que hace que la proteína envíe una señal que inicia los efectos de los opioides.
Esencialmente, medicamentos como el fentanilo, al actuar sobre el receptor, transmiten cambios físicos a las proteínas G que resultan en un cambio más rápido del interruptor. Lo que vemos ahora es que la naloxona bloquea el mecanismo, impidiendo que el interruptor se active y envíe una señal.
Atrapando el interruptor
Los investigadores saben que los efectos de los opioides se desencadenan cuando se activa el interruptor de la proteína G. Pero, ¿cómo es este proceso?
Durante años, los intentos de visualizar este mecanismo se limitaron en gran medida a dos estados: antes de que la proteína G se una al receptor opioide µ y después de que la molécula se haya liberado de la proteína G. Los estados intermedios se consideraban demasiado inestables para aislarlos. Mi equipo y yo queríamos capturar estos estados invisibles momento a momento a medida que se activa el interruptor y se libera la molécula.
Para ello, utilizamos una técnica llamada microscopía crioelectrónica, que congela moléculas en movimiento para visualizarlas con una resolución casi atómica. Tanto para la naloxona como para el fármaco opioide loperamida (Imodium), capturamos la proteína G unida al receptor opioide justo antes de que liberara la molécula.
Captamos cuatro estados estructurales diferentes que condujeron a la liberación de la molécula de la proteína G.
El primero de ellos, al que llamamos estado latente, es la forma más temprana del receptor opioide y la proteína G después de que entran en contacto. Descubrimos que tanto el receptor de opioides como la proteína G están inactivos en este momento. Además, la naloxona estabiliza este estado latente. Esto significa que la naloxona bloquea eficazmente el mecanismo desde el principio, impidiendo todos los pasos posteriores necesarios para la activación.
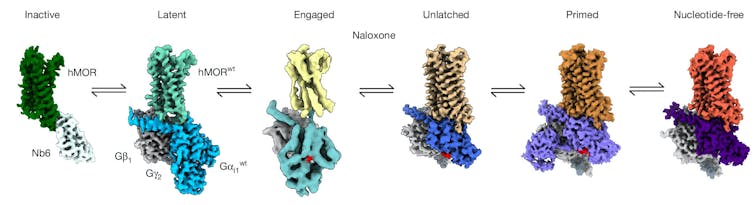
La forma en que están configurados el receptor µ-opioide (mitad superior de la estructura) y la proteína G (mitad inferior de la estructura) es crucial para los efectos de la naloxona y los opioides. Saif Khan y otros/Nature, CC BI-NC-ND
En ausencia de naloxona, el fármaco opioide promueve una transición a los tres estados restantes: la proteína G gira y se alinea con el receptor (activada), abre una puerta bloqueando la molécula que activaría el interruptor (desbloqueada) y mantiene esa puerta abierta para que la molécula pueda liberarse (el efecto del fármaco aplicado).
Para confirmar que nuestras grabaciones reflejan lo que realmente está sucediendo, realizamos extensas simulaciones por computadora para observar cómo estos cuatro estados cambian con el tiempo. En conjunto, estos hallazgos apuntan a la raíz molecular de los efectos terapéuticos de la naloxona: al detener el receptor de opioides y la proteína G en estado latente, desactiva la señalización de opioides, revirtiendo la sobredosis de opioides en cuestión de minutos.
Visualización de nuevos fármacos.
Diseñar una nueva llave para una cerradura tiene más éxito cuando se sabe exactamente cómo es la cerradura. Al mapear la secuencia exacta de cómo los opioides interactúan con los receptores opioides y señalar dónde pueden intervenir diferentes fármacos en este proceso, nuestros hallazgos proporcionan un modelo para diseñar la próxima generación de fármacos opioides y antídotos para las sobredosis.
Por ejemplo, uno de los desafíos persistentes con la naloxona es que a menudo hay que administrarla varias veces durante una sobredosis. Este es especialmente el caso de la sobredosis de fentanilo, donde el opioide puede anular o sobrevivir a los efectos del tratamiento.
Saber que la naloxona actúa deteniendo el receptor µ-opioide en un estado latente temprano sugiere que las moléculas que pueden unirse de manera más estrecha o selectiva a esta forma de receptor podrían ser más efectivas para estabilizar este estado inactivo y así prevenir los efectos de los opioides.
Al desentrañar la estructura de las moléculas implicadas en la señalización de los opioides, los investigadores podrían desarrollar fármacos que proporcionen una protección más duradera contra las sobredosis.
.webp)

0 Comentarios